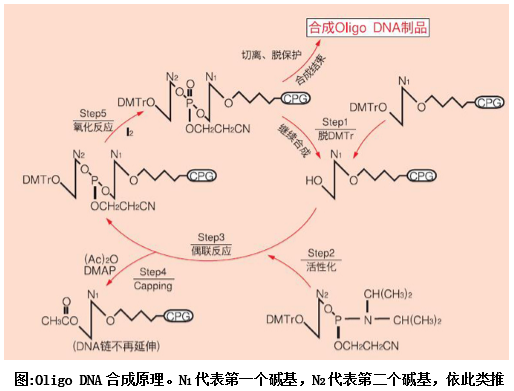
Oligo DNA的人工化学合成始于50年代初期,1980年,全自动的固相DNA合成仪面市后,使得快速、高效合成Oligo DNA成为可能,这大大地推动了生物工程技术的蓬勃发展。
现在一般都采用β-乙*亚磷酰胺化学合成Oligo DNA,将DNA固定在固相载体上完成DNA链的合成的合成时从3' →5' 方向进行,通常3' 端的第一个碱基结合在Glass担体 (Controlled Pore Glass,CPG)上。其具有高效、快速的偶联以及起始反应物比较稳定的特点。
合成步骤
Step1:脱掉附加在CPG担体上的第一个碱基5' -OH基团上的保护基 (DMTr),准备附加下一个新的碱基;
Step2:活化新的碱基单体 (Phosphoramidite),准备与第一个碱基进行反应;
Step3:第二个碱基与第一个碱基发生偶联反应;
Step4:将没有反应的第一个碱基的5' -OH加帽封死 (Capping),使其不再进一步参与反应;
Step5:将核苷亚***氧化成更稳定的核苷*** (即将三价磷氧化成五价磷);
Step6:重复进行Step1~Step5的循环,直至合成完所需的Oligo DNA序列;
Step7: 合成结束后,将Oligo DNA分子从CPG上切下,再进行进一步的纯化。
OD数的确定
一般PCR扩增,2 OD引物,可以做200-500次50ul标准PCR反应。如果是做基因拼接或退火后做连接,1 OD就足够了。但是有些研究人员,就做几次PCR,但是却要5-10 OD。做全基因构建的引物都比较长,但是我们有些研究人员也要求高OD数。片段越长, 最后全长得率就越低,出错的几率就越大。超出需要之外的OD数要求,也是一种浪费。
引物纯度检测
实验室方便的作法是用PAGE方法。使用加有7M尿素的16%的聚丙烯酰胺凝胶进行电泳。取0.2-0.5OD的引物,用尿素饱和液溶解或引物溶液中加入尿素干粉直到饱和,上样前加热变性(95℃,2mins)。加入尿素的目的一是变性,二是增加样品比重,容易加样。600V电压进行电泳,一定时间后(约2-3小时),剥胶,用荧光TLC板在紫外灯下检测带型,在主带之下没有杂带,说明纯度是好的。如果条件许可,也可以用EB 染色或银染方式染色。
引物级别选择
小编提醒:下一期,更多精彩内容与您分享,敬请期待!
如何低成本研究空间转录组?看完这篇文章你或许会有答案
(2022-06-02T14:51 浏览数:5709)
【周二晚八点】从位置到功能--空间转录组应用
(2022-05-16T08:59 浏览数:6515)
Cell Reports:利用空间转录组解析哺乳动物精子生成
(2022-04-28T14:54 浏览数:7671)
RNA二级结构调控基因表达的研究现状和进展
(2022-04-21T13:39 浏览数:5625)
Nature: MERFISH绘制小鼠初级运动皮层空间细胞图谱
(2022-04-18T13:24 浏览数:4428)
大自然的恩赐-外泌体药载
(2022-04-08T13:43 浏览数:5922)
【详解】基于图像的单细胞空间分辨转录组学技术
(2022-04-01T11:18 浏览数:9945)
知无不“研”,五分钟带你了解空间分辨转录组学的前世今生
(2022-03-18T14:00 浏览数:6738)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:5206)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:5723)