宿主细胞的代谢重编程在病毒感染过程中起着至关重要的作用。衣康酸是三羧酸循环( TCA )中的代谢产物,由免疫应答基因1(IRG1)编码的乌头酸脱羧酶(ACOD1)使顺乌头酸脱羧产生,参与调节先天免疫反应和病原体感染。然而,其在病毒感染中的作用及其机制尚不完全清楚。
2024年12月27日,海军军医大学免疫与炎症全国重点实验室于益芝教授、徐胜教授、邹最教授团队在Signal Transduction and Targeted Therapy(IF 40.8)上发表研究论文“Itaconate facilitates viral infection via alkylating GDI2 and retaining Rab GTPase on the membrane”。研究揭示了中性粒细胞来源的衣康酸通过Rab GTP酶的重新分配促进病毒感染,可能是抗病毒治疗的潜在靶点。

· 维真助力 - AAV·
基因信息:GDI2,GDP解离抑制因子β
病毒产品:AAV-GDI2-shRNA,AAV-scrambled-shRNA
注射方式:气管内注射
注射剂量:50μL,1×1013vp/mL
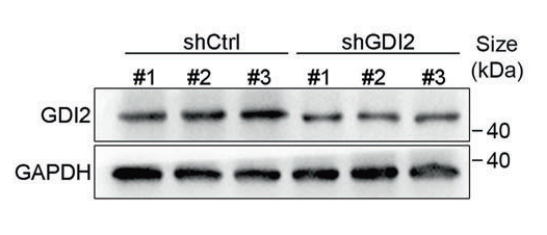
WB结果表明AAV-GDI2-shRNA敲低了GDI2表达
研究结果
1、IRG1通过衣康酸促进VSV和IAV感染
首先,作者研究了病毒感染后的代谢变化,发现衣康酸是肺脏中被病毒诱导产生的主要代谢产物,进一步研究发现衣康酸及其衍生物OI可以促进VSV和IAV的感染,并且独立于IFN-I信号传导。作者研究了内源性衣康酸合成酶IRG1对病毒感染的影响,病毒感染后,Irg1在代谢基因中明显上调,病毒感染诱导巨噬细胞中IRG1的显著表达和衣康酸的产生。功能上,Irg1缺陷减轻了VSV和IAV感染,导致IFN-I产生减少,ISGs表达减少,以及TBK1-IRF3信号通路激活。Irg1沉默仍然阻碍了Irf3-/-巨噬细胞中的VSV感染,以上表明内源性IRG1通过独立于IFN-I的方式提高了巨噬细胞对VSV和IAV感染的易感性。利用OI治疗IRG1-/-巨噬细胞,在Irg1-/-巨噬细胞中补充OI大大增强了VSV感染,并挽救了由Irg1缺乏引起的受损病毒感染,即使在IFN-I缺乏的情况下也是如此,表明IRG1通过衣康酸并且独立于IFN-I促进病毒感染。
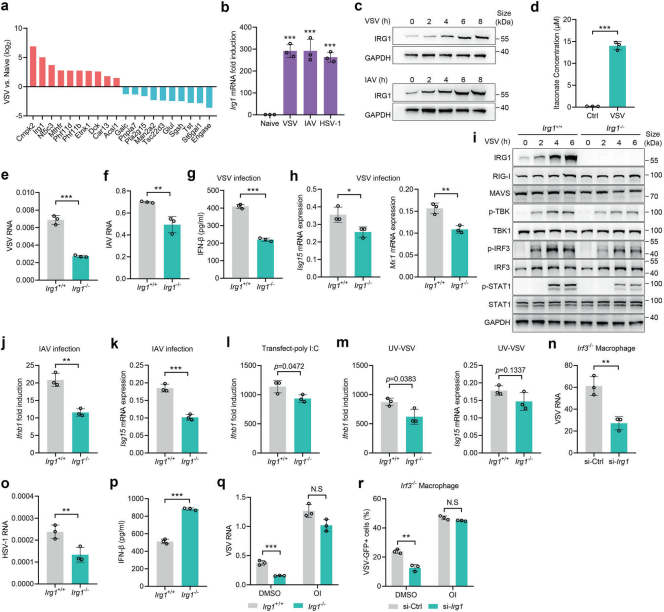
图1.IRG1以不依赖IFN-I途径促进VSV和IAV感染
2、衣康酸促进Rab GTP酶的膜定位
接下来,作者研究了衣康酸促进VSV和IAV感染的潜在机制。研究发现OI促进VSV感染不是通过调节抗氧化反应或葡萄糖代谢来介导的,而类异戊二烯尤其是GGPP,可能与OI对病毒感染的影响有关。作者研究了OI是否影响GGPP催化酶GGTase-I和GGTase-II经典靶蛋白的亚细胞定位,发现OI对GGTase-I靶蛋白的分布没有影响,但显著增加了GGTase-II的经典靶点Rabs的膜定位。Rab5和Rab7分别定位于早期内体和晚期内体,在OI处理后表现出更大的内体膜定位倾向。此外,OI对Rabs分布的调节作用可由GGTase-II抑制剂3-PEHPC或辛伐他汀阻断GGPP产生而消除;3-PEHPC消除了OI对VSV和IAV感染的促进作用,衣康酸处理后也得到类似的结果。以上数据表明OI增强了Rabs在膜上的亚细胞分布,而GGTase II介导的香叶基香叶基化是调节Rabs定位和增强OI病毒感染所必需的。作者继续探究了IRG1衣康酸轴影响病毒感染的具体生命阶段,发现IRG1衣康酸轴促进病毒进入和进入后过程。
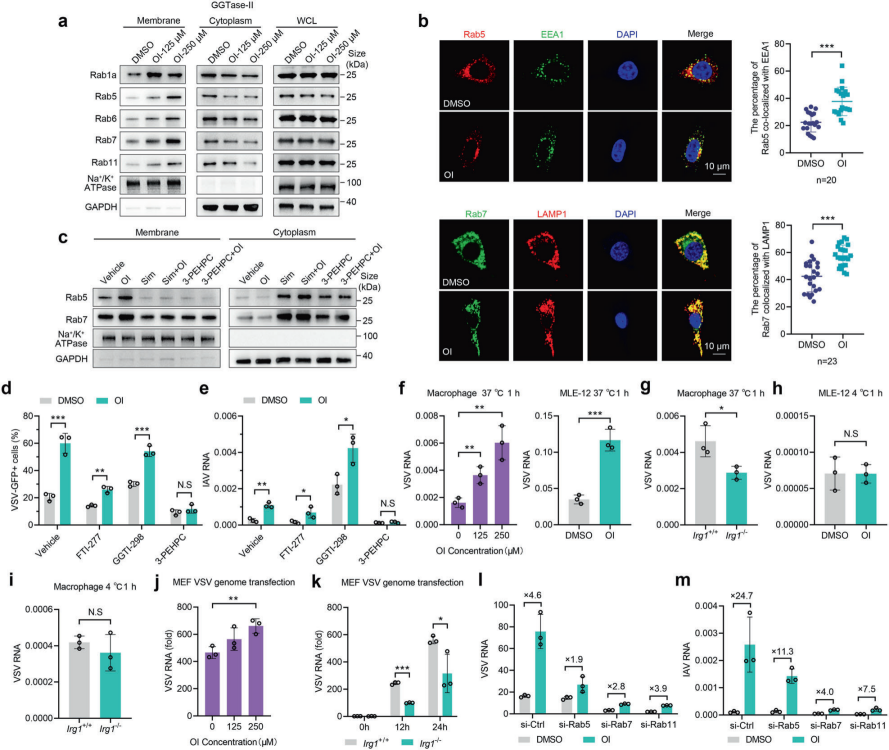
图2. OI诱导Rab GTP酶重新分布以增强病毒感染
3、GDI2的衣康酰化阻碍了Rab GTP酶从膜上的提取
Rabs在膜和细胞质之间穿梭,受到各种蛋白质的严格调控。Rab-GDP解离抑制剂(GDI1和GDI2)与Rabs非活性形式上的香叶基香叶基化基团结合,并将其从膜中提取出来,使其可用于另一轮膜递送,GDIs的功能障碍导致Rabs滞留在膜内。为了确定OI诱导的病毒过度生长是否依赖于GDI,作者分别沉默了GDI1和GDI2。值得注意的是,沉默GDI2而不是GDI1可以消除OI引起的VSV和IAV感染的促进作用。OI抑制GDI2介导的Rabs从膜中提取,导致Rabs在膜上的分布增强,促进病毒感染。GDI2是衣康酰化的直接靶点,添加衣康酸会导致GDI2上C203/335/414残基的衣康酰化,从而破坏GDI2和Rabs之间的相互作用,增加Rabs的膜分布,最终促进病毒过度生长。最后,用含有GDI2 shRNA的AAV对小鼠进行鼻内给药,以建立GDI2敲低模型。敲低GDI2促进了肺组织中的病毒感染,同时也消除了OI治疗引起的VSV和IAV感染的促进作用。这些发现表明,GDI2抑制VSV和IAV感染,而OI通过在体内修饰GDI2促进病毒感染。
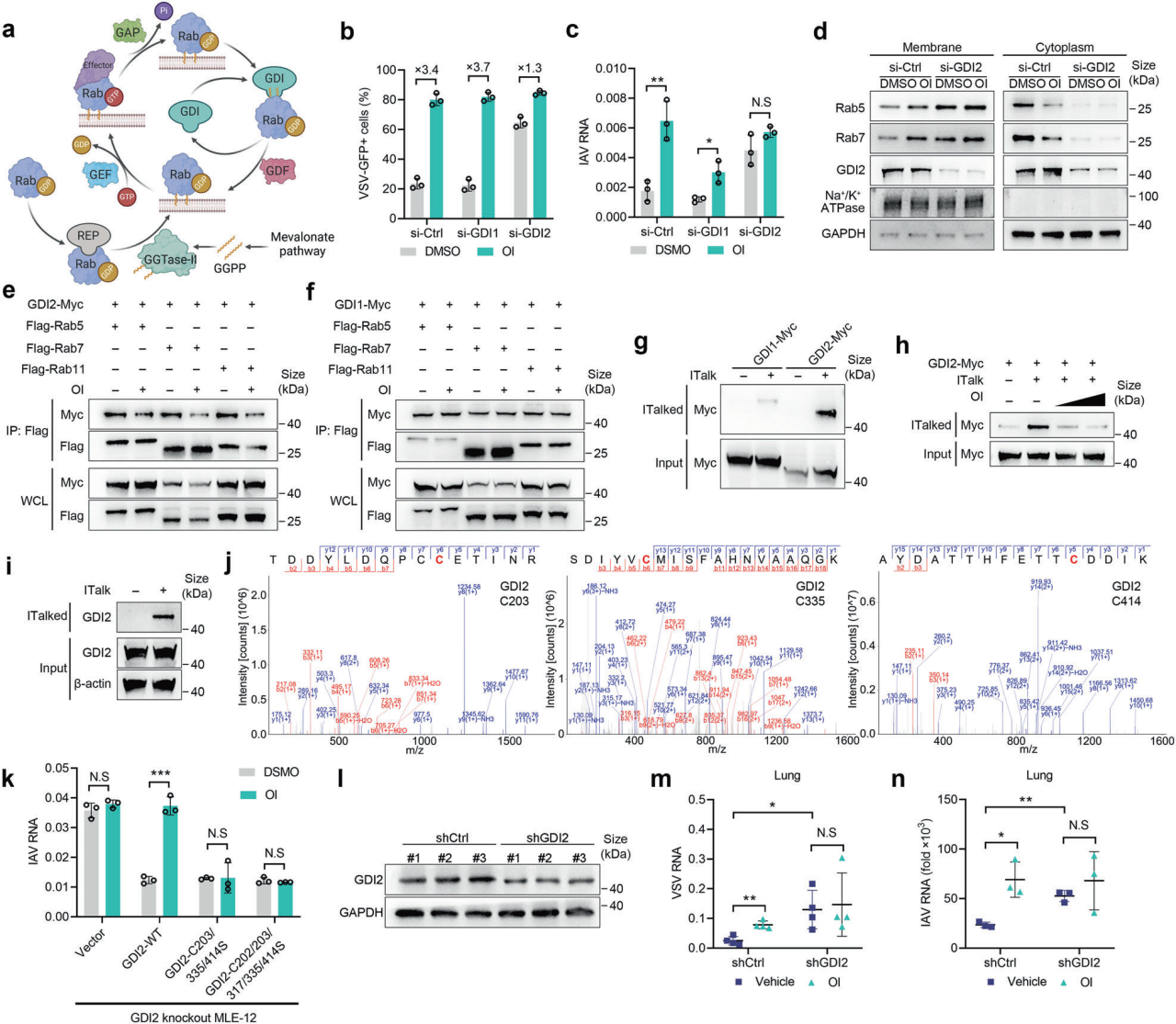
图3. OI抑制通过GDI2烷基化从膜中提取Rabs
4、中性粒细胞中的IRG1衣康酸轴调控体内病毒感染
病毒感染诱导中性粒细胞IRG1衣康酸轴的强烈激活,鉴于IRG1在病毒感染期间主要在中性粒细胞和巨噬细胞中表达,CD45-非免疫细胞IRG1表达最低,作者接下来研究了IRG1-衣康酸轴是否通过免疫细胞产生IRG1免疫谱系缺陷小鼠来调节体内病毒感染。结果表明免疫细胞中的IRG1衣康酸轴增强了体内病毒感染,并诱导了更强的免疫反应。为了进一步确定中性粒细胞来源的衣康酸的作用,作者在Irg1+/+和Irg1-/-小鼠中用抗Ly6G抗体耗竭中性粒细胞。与同窝对照组相比,Irg1-/-小鼠在感染后病毒载量显著降低,同时细胞因子产生和病理损伤减少。然而,中性粒细胞的耗竭消除了Irg1+/+和Irg1-/-小鼠之间的差异。因此,中性粒细胞在IRG1衣康酸轴对病毒感染的影响中起着主要作用。
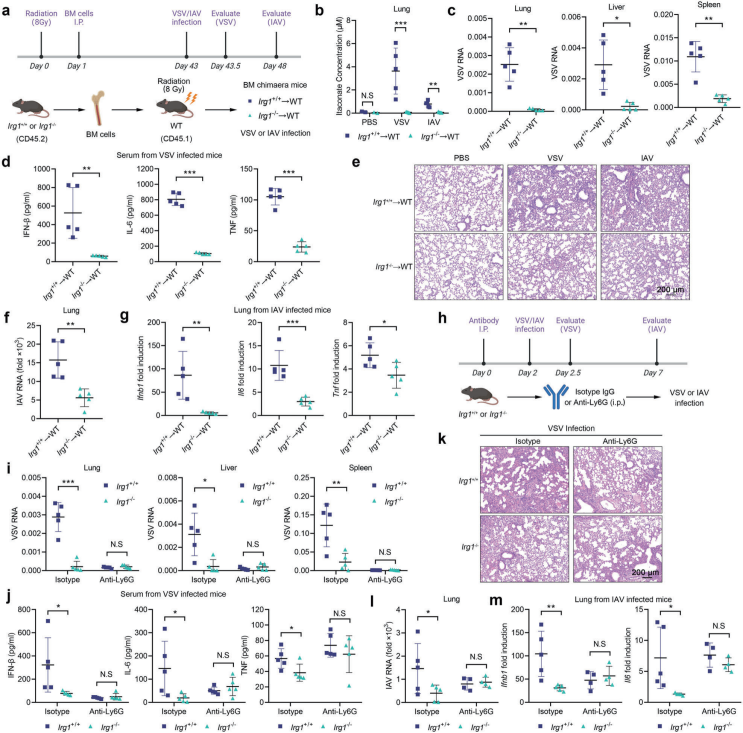
图4.中性粒细胞衍生的衣康盐促进VSV和IAV感染
小结
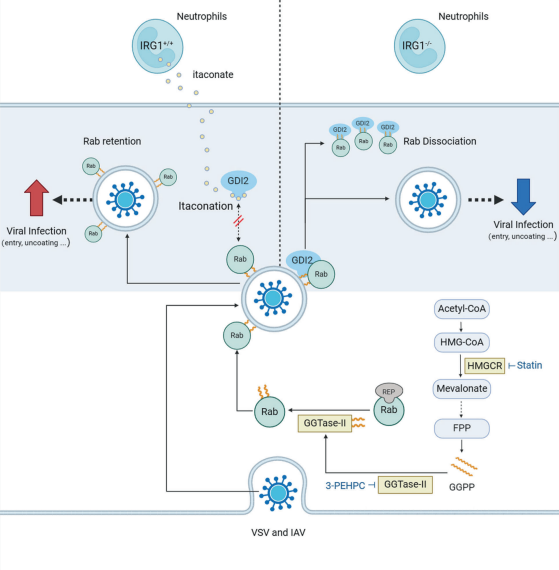
综上,本研究发现来自中性粒细胞的衣康酸盐通过直接烷基化GDI2并将Rab GTP酶保留在膜内来促进病毒感染。这一发现增强了对病毒感染中IRG1衣康酸轴的理解,并强调了IRG1是某些病毒感染的潜在治疗靶点。
