
期刊:gut
影响因子:24.5
导语
慢性胰腺炎(CP)是一种可能致命的外分泌胰腺疾病,目前尚无特效或有效的治疗方法。由于难以获得胰腺组织,人们对人类CP的局部免疫反应或发病机制知之甚少。我们试图使用来自CP和非CP器官供体不同病因患者的组织来表征胰腺免疫反应,以鉴定与人类CP相关的关键信号分子。
研究技术
我们通过对来自器官供体、遗传性全胰腺切除术和特发性CP患者的胰腺免疫细胞进行测序和t细胞受体(TCR)测序,对转录组和表位进行单细胞水平的细胞索引。我们通过对第二例CP队列患者进行流式细胞术和功能分析来验证基因表达数据。
研究路线
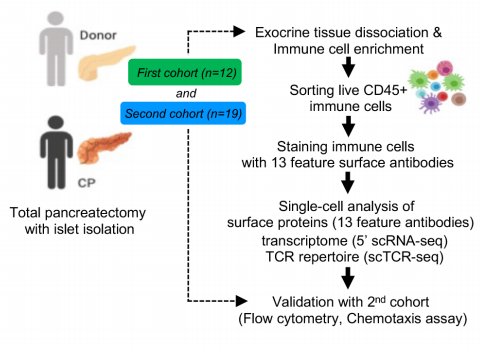
研究结果
1. 人胰腺免疫细胞转录图谱揭示了CP中独特的疾病特异性特征
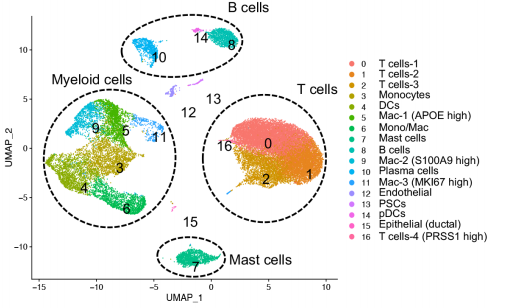
从捐赠者(n=3)和CP患者(遗传n=5和特发性n=4)收集胰腺组织,分选免疫细胞,用13种不同的表面蛋白抗体进一步染色,后进行scRNA-seq和scTCR-seq。质控后获得28547个细胞,分17个cluster。鉴定出的主要免疫细胞是T细胞、髓系细胞、B细胞和肥大细胞。
进一步分析发现,对照胰腺组织的主要免疫细胞是髓系细胞,而CP组织的胰腺免疫细胞主要是T细胞。巨噬细胞,包括cluster5、9和11,在对照组中富集;t细胞簇在CP组中扩大,cluster2是遗传性CP中富集的主要t细胞簇,而cluster0在特发性CP中占优势。对CP与对照组之间的DEGs进行了GSEA分析,结果有炎症反应的强烈特征,包括细胞凋亡、缺氧、白细胞介素2-STAT5、干扰素和肿瘤坏死因子(TNF)-α信号通路。总的来说,来自对照组和CP组织的胰腺免疫细胞分析表明,局部致病组织区域存在疾病特异性免疫反应,遗传性和特发异性CP组之间有不同的免疫转录组和蛋白表达特征。
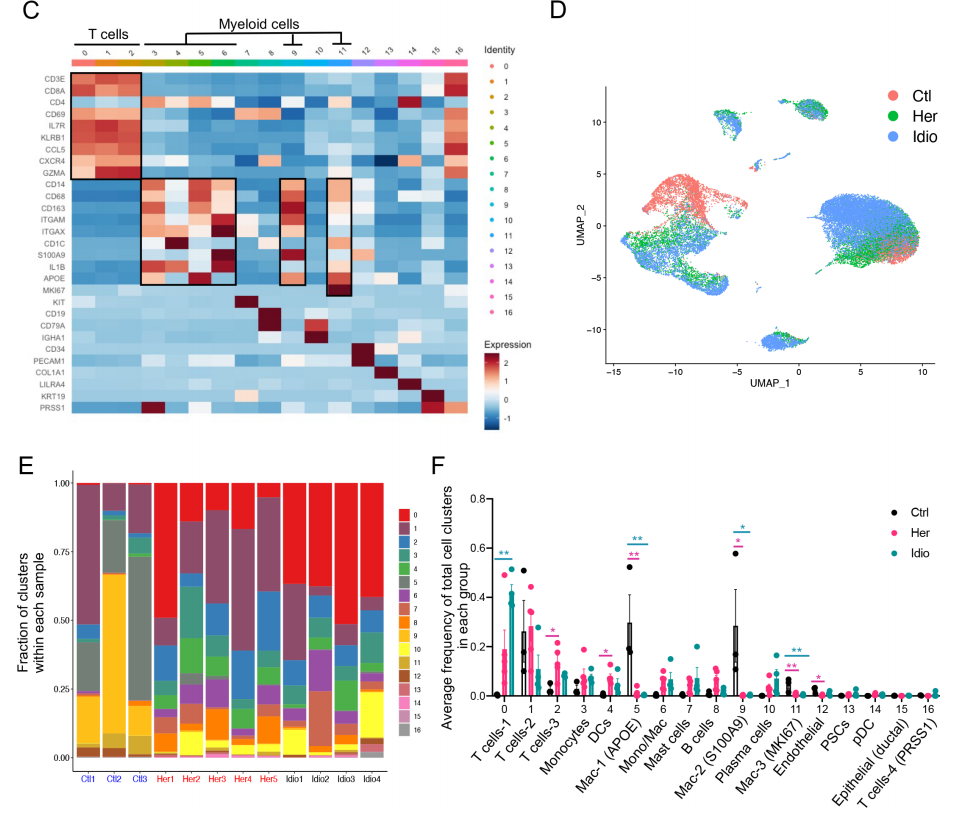
2. 遗传性和特发性CP之间的胰腺T细胞的不同转录组特征
在对照组和CP患者胰腺中存在的主要免疫细胞群是T细胞。分析了T细胞亚群(cluster0、1和2),共15 913个细胞,鉴定了13种不同的T细胞。UMAP显示细胞簇明显分为三组:对照组、遗传性CP和特发性CP。对照细胞主要由GZMA+细胞毒性CD8+ T细胞组成,遗传性CP细胞主要由CD4+ Th亚群组成,包括CCR6+、TNF+(Th1)、调节性T(Treg)细胞和HLA-DA+ CD8+ T细胞。然而,FTH1+ CD4+和BAG3+ CD8+ T细胞是特发性CP样本中主要的T细胞。分析了遗传性CP与特发性CP相比,在总T细胞、CD4+ T细胞或CD8+ T细胞中的DEGs。与特发性CP相比,其中一些基因在遗传性基因中表达上调,它们包括趋化受体和配体,如CCR6、CXCR4、GPR183和CCL20,表明它们参与了遗传性CP中CD4+T细胞的募集。
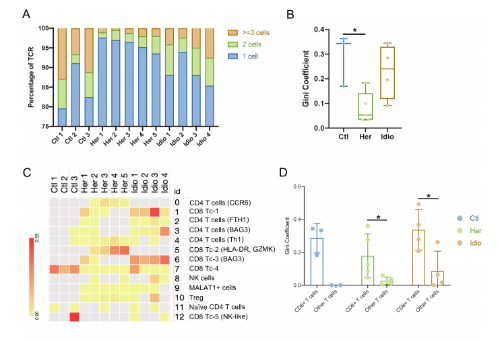
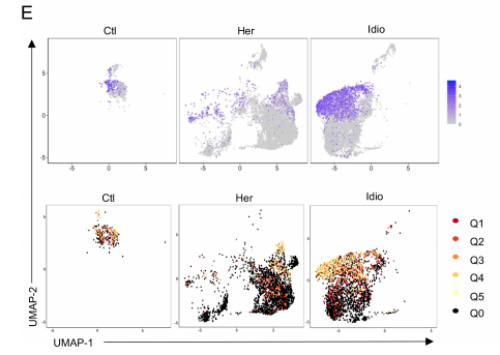
3. 在CP中,CD8+T细胞依赖的独特的TCR库变化
从对照和CP的12个样本中,共鉴定了5180个T细胞,12 856对特异的αβ TCR序列。在对照组T细胞中,15.6%±6.0%独特的克隆型由两个或两个以上的细胞共享,显著高于遗传性CP T细胞(4.03%±1.6%)。与此结果相对应,对照组T细胞的Gini coefficient(克隆性指数)也显著高于遗传性CP组,表明在遗传性CP的T细胞中,克隆扩增率较低。不同T细胞簇的Gini coefficient显示在对照和 CP组CD8+ T细胞倾斜克隆扩增。当把T细胞分为CD8+ T细胞和其他T细胞时,CD8+ T细胞的基尼系数明显高于其余T细胞。通过比较CD8A基因表达的UMAPs和克隆扩增的细胞群,进一步证实了这一结果。

4. 在CP中,t细胞谱系和共享的抗原结合基序之间的独特的相互作用
为了解T细胞簇之间的联系和起源,通过分析所有组或每个组内的克隆型,检查了独特的克隆型(匹配的单细胞TCR-αβ谱)和它们在不同cluater之间的重叠。在 CD8+ cytotoxic T-cell clusters (Tc-1 and Tc-3)之间发现了最大的克隆型重叠,它们有40个共享的克隆型,主要由特发性CP组驱动。有63 个独特的克隆型在特发性CP的CD8+ cytotoxic T-cell clusters中发现了共享的克隆型。CCR6+ CD4+ T细胞与Th1细胞之间的克隆型重叠最高,有23个共享克隆型,这些重叠主要发生在遗传性CP中。这些共享的TCR克隆型阐明了不同t细胞亚型之间的独特相互作用和每个CP组的克隆动力学。
为了检验在对照组和CP样本中发现的胰腺TCR是否识别相同的抗原,通过GLIPH2分析筛选TCR CDR3β氨基酸序列上共享的抗原结合基序来识别相同表位的集群TCR。根据最终的评分,从所有三组(对照组和两个CP组)中选择了至少两个个体共享的基序,其中显示了三个聚类,因为它们在配对的CDR3α序列中也具有一定程度的相似性。结果显示,所选的集群主要由遗传性和特发性CP组的个体共享,而不是对照组。值得注意的是,三个具有独特共同基序的候选簇中的大多数tcr主要由遗传性CP组的个体共享,这表明遗传性CP中的T细胞更有可能对共同抗原或表位发生反应。

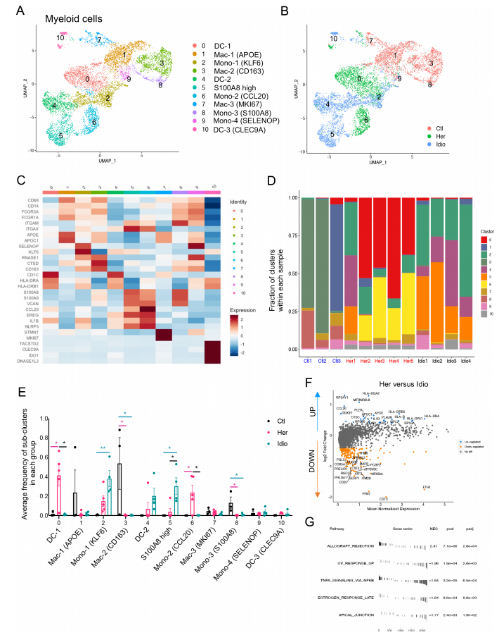
5. 人胰腺髓系细胞的明显转录改变
髓系细胞是在对照组和CP受试者的胰腺中发现的胰腺免疫亚群的另一个关键组成部分。进一步对髓系的亚群(clusters 3, 4, 5, 6, 9 and 11)进行细分,鉴定出11个不同细胞亚群,包括单核细胞、巨噬细胞和树突状细胞(DC)。并且每组细胞(对照组、遗传性CP或特发性CP)聚集在一起,重叠最小。与CP患者比较,CD68+和CD163+巨噬细胞和S100A8+单核细胞(clusters3和8)的频率显著升高。遗传性CP中CCL20+单核细胞的频率明显高于对照组或特发性CP样本。CP患者与对照组的DEG分析显示了各种炎症和趋化分子,如IL1B、CXCL2、CXCL3、CXCL8和CCL4,这些分子在富集的CP髓系细胞中显著上调和炎症信号通路。遗传性CP与特发性CP的DEG分析发现包括HLA-DR、CCL20和IL1B显著上调。
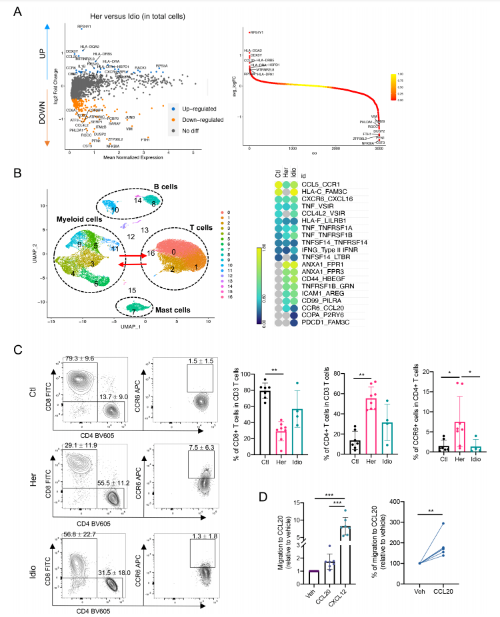
6. 在遗传性CP,CCR6-CCL20轴功能分析
与遗传性CP的CD4+ T细胞和单核细胞群体中CCR6-CCL20轴的基因的转录表达一致,通过分析总免疫细胞群的差异,比较遗传性CP和特发性CP,证实了这种独特的趋化因子和受体轴的参与。遗传性CP和特发性CP相比,CCR6和CCL20是显著上调的前20个基因之一。此外,为了评估髓系细胞和T细胞之间的串扰,通过受体配体的表达水平分析了髓系细胞和T细胞区室之间的细胞因子或趋化因子受体-配体的相互作用。CCR6-CCL20轴仅在两组CP中表达,遗传性CP中CCR6-CCL20的表达明显高于特发性CP。最后,通过流式细胞术检测了从第二组对照组和CP患者中分离出来的T细胞中CCR6蛋白的表达。与对照组相比,遗传性CP中CD8+ T细胞的频率显著降低,而CD4+ T细胞的频率显著升高。与scRNA-seq结果一致,特发性CP中CD8+或CD4+ T细胞的频率介于中间,介于对照组和遗传性CP之间。与对照组或特发性CP相比,遗传性CP中表达CCR6的CD4+ T细胞的百分比显著增加。遗传性CP样本的CD4+ T细胞中CCR6蛋白表达升高后,通过ELISA检测了遗传性CP中胰腺单核细胞分泌的CCL20。此外,通过免疫荧光验证,在遗传性CP的胰腺组织切片CCR6+和CCL20+细胞分别与CD4+和CD45+免疫细胞共定位。接下来,通过ccl20介导的细胞迁移实验来评估T细胞中CCR6表达的功能意义。
进行Transwell趋化,CXCL12作为阳性对照,来自遗传性CP组织的胰腺免疫细胞向可溶性重组人CCL20迁移,其浓度与以前的报道相当。胰腺浸润性T细胞对CCL20的趋化反应性的增加证实了遗传性CP中受体(CCR6)表达的增加的功能意义。这些数据表明,T细胞通过CCR6-CCL20轴迁移并浸润遗传性CP中的病变胰腺。
参考文献:
Lee Bomi,Namkoong Hong,Yang Yan et al. Single-cell sequencing unveils distinct immune microenvironments with CCR6-CCL20 crosstalk in human chronic pancreatitis.[J] .Gut, 2022, 71: 1831-1842.
