题目:Quantitative Map of Proteome Dynamics during Neuronal Differentiation
期刊:Cell Reports
影响因子:8.032
研究背景
神经元分化是一个多步骤过程,一般经过几个阶段,包括轴突生长、树突发生和突触形成、塑造和重塑神经元。但是对神经元分化过程中系统生物学动态变化研究多集中在转录组水平,基因在转录水平的变化不一定能代表最终功能执行者蛋白质的变化。因此,有必要系统的研究神经分化过程中蛋白质的动态变化。
研究内容及结果
1. 大鼠海马神经元蛋白表达谱
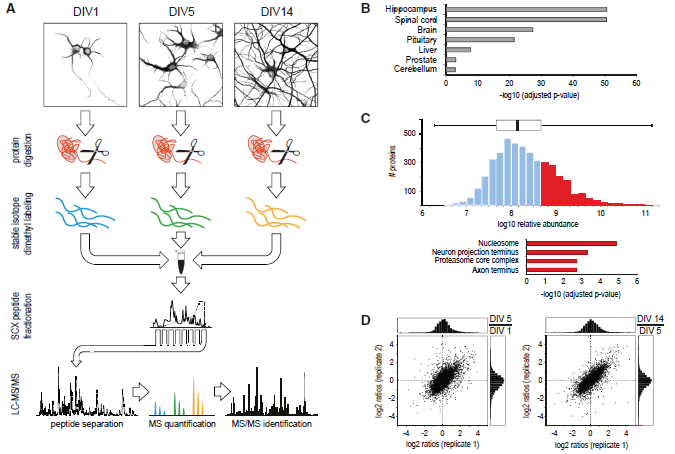
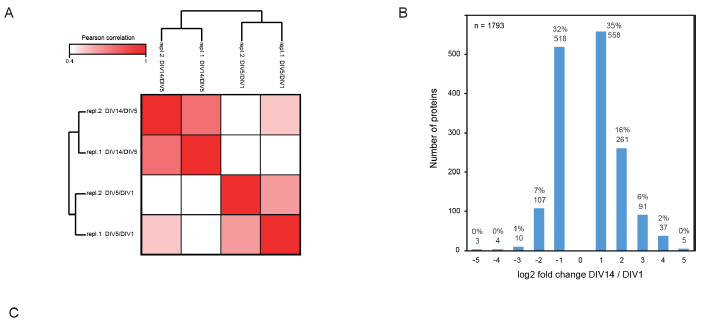
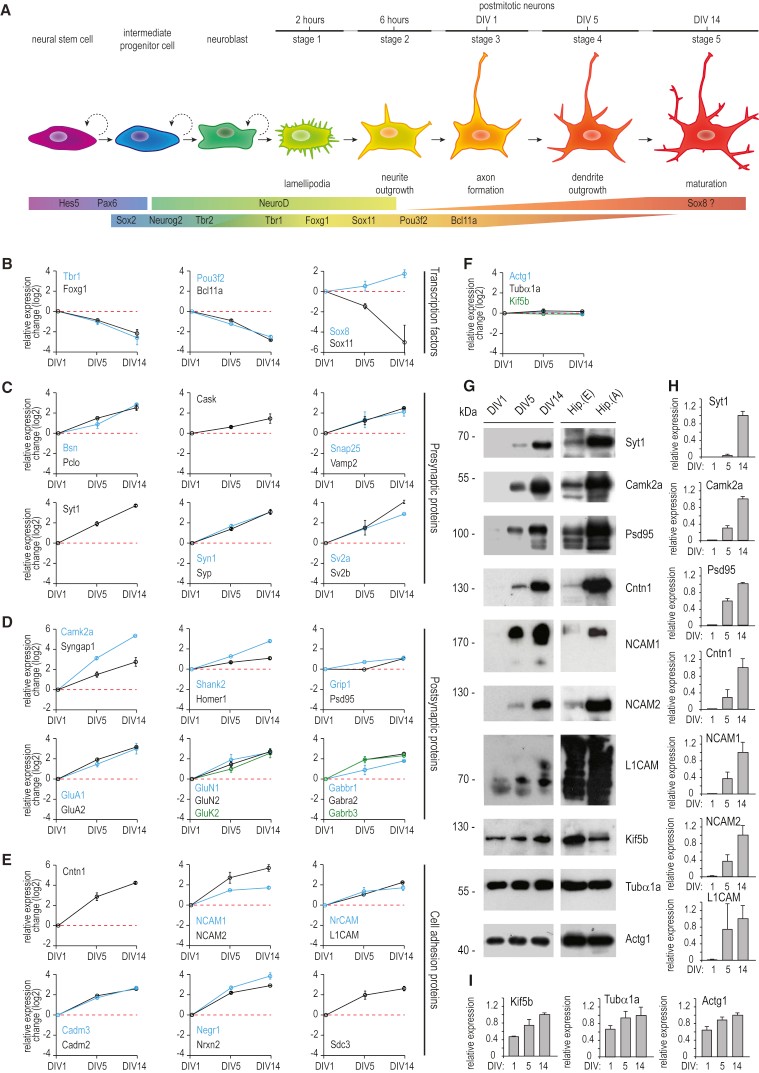
为了分析分化过程中神经元蛋白质组的改变,作者将大鼠原代海马神经元在无血清的神经基质培养基中培养生长,并收获轴突形成期DIV1、树突生长期DIV5、突触发生和成熟期DIV14细胞,使用蛋白质组学技术对不同时期的细胞进行质谱检测定量分析(图1A)。总共鉴定到了6753个蛋白,其中4354个蛋白有定量信息,有1793个蛋白质发生超过2倍的表达量变化(|log2(FC)| > 1),表明在神经元分化过程中至少有1/3的神经元蛋白发生重构(图2B)。以Rattus norvegicus蛋白质数据库作为背景的富集分析结果显示,本次组学数据已涵盖了大鼠海马神经元大部分特异性蛋白(图1B),平均相对蛋白丰度跨越5个数量级(图1C),位于轴突和神经末梢的蛋白质是除常见的核小体蛋白质和蛋白酶体之外丰度最高的蛋白质。Pearson相关性分析表明本次实验生物学重复之间的相关性良好(图1D,图2A)。
图1 海马神经元发育分化定量蛋白质组学分析
图2 生物学重复性分析和差异蛋白分析
2. 神经元分化过程中蛋白质组动态变化
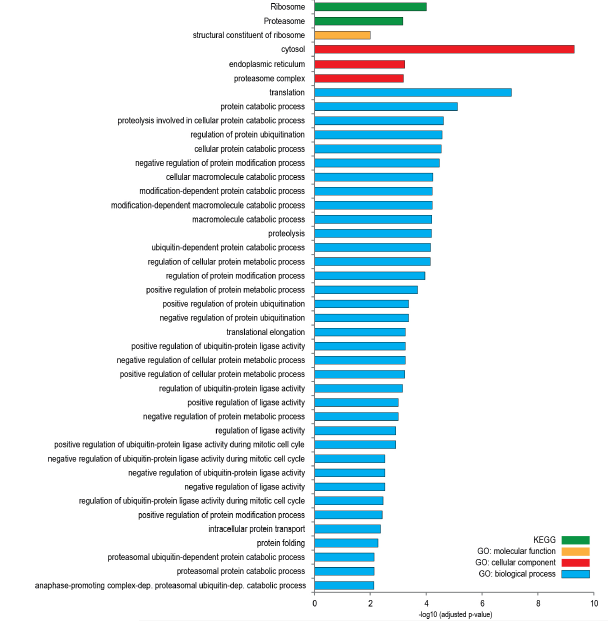
作者对定量到的4354个蛋白质在不同发育阶段表达量进行深入分析,表达量没有发生明显改变的蛋白质多参与生物过程,如翻译、蛋白分解代谢、蛋白酶体等(图2C),这说明在神经元分化期间蛋白质组重塑过程中全局蛋白质周转率基本上不受影响。
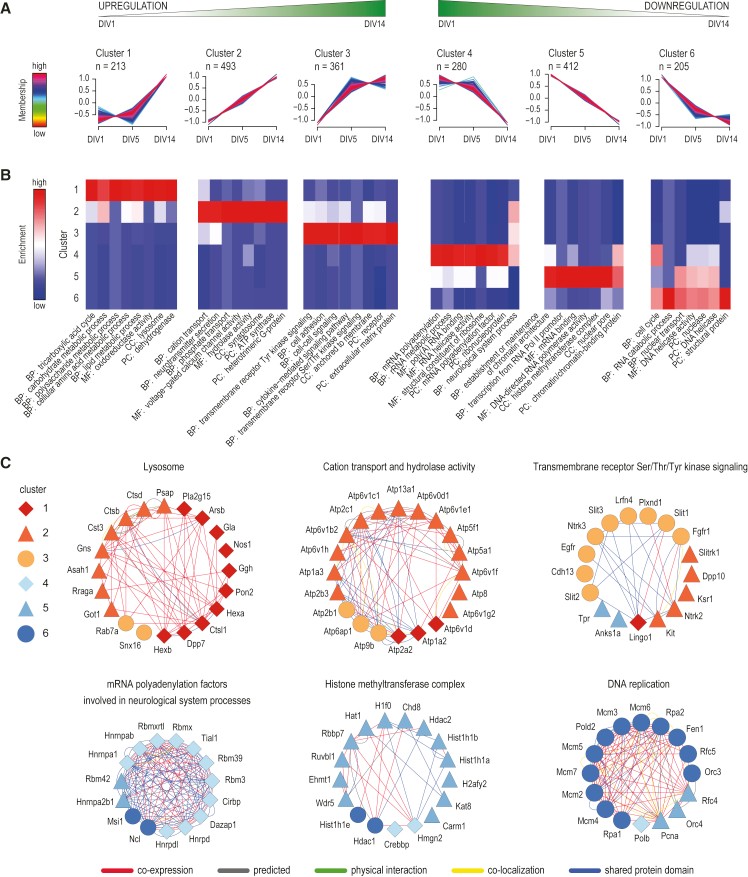
为了获得神经元分化过程中蛋白质组表达动态变化,作者对所有表达量显着变化的蛋白质进行表达模式聚类分析,发现有6种表达模式(图3A)。其中蛋白质在Cluster 1、2和3中的分化期间上调,在Cluster 4、5和6中的分化期间下调。此外,功能注释分析显示特定Cluster内许多蛋白在细胞成分、分子功能以及生物过程方面具有共同的特性(图3B)。Cluster6含有从DIV1到DIV5显著下调的蛋白质,参与早期神经元分化期间精确定时的下调,以细胞周期调控和DNA复制等多种蛋白为主(图3C),Cluster5中的蛋白随时间持续下调,富含与染色质相关的蛋白质,Cluster4中的蛋白质表现出从DIV5到DIV14的显著下调,该Cluster中的许多蛋白质与RNA代谢相关,Cluster3中的蛋白从DIV1到DIV5显著上调,其中许多蛋白质与细胞粘附和细胞信号相关,Cluster2中的蛋白从DIV1到DIV14一直在显著上调,主要是与阳离子传输和神经递质分泌有关的蛋白质,Cluster1中的蛋白从DIV5到DIV14显著上调,其中包含了参与多糖、氨基酸和脂类代谢在内的多种代谢过程的蛋白质。
图3 神经元分化过程中动态蛋白质组重塑
3. 神经元发育过程中的突触和细胞粘附蛋白质分析
作者随后研究突触发生过程中蛋白表达动态变化,这是神经元发育中的一个关键事件,需要协调组装高度连接的蛋白质网络,包括支架蛋白、受体及其下游靶标、信号分子和细胞粘附蛋白。培养期间海马神经元发育期间的突触形成发生在DIV5至第DIV14阶段,大多数差异表达的突触蛋白被分配到Cluster2,这表明从DIV1到DIV14的相对蛋白质水平稳定增加,这些蛋白多为参与囊泡运输(Syp、Syt1)、细胞骨架组织和蛋白质锚定(Cask、Pclo、Bsn)、神经递质释放(Syn1、Vamp2、Snap25、Sv2a、Sv2b)的重要突触前蛋白(图4C)。为了验证定量蛋白质组学数据,作者进行对应时间点的WB实验(图4G-I),证实了在后期发育阶段相应蛋白上调的表达水平。
细胞粘附分子是另一类重要的蛋白质,在神经元发育中起关键作用。它们介导轴突寻路和轴突-树突接触形成,并进一步调节树突棘形态和突触可塑性。在作者的组学数据集中定量了82种细胞粘附蛋白,包括Cntn1、NrCAM、Nrxn2、NCAM1和NCAM2等(图 4E),其中有 24个蛋白存在于Cluster3(图3A)。
图4 神经元分化过程中蛋白质表达的变化
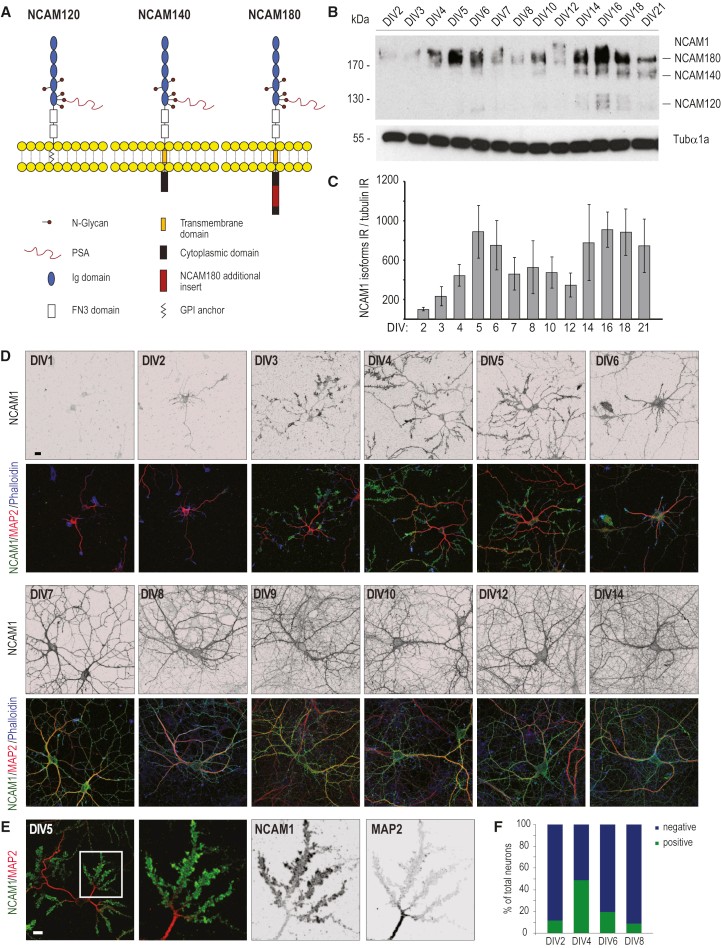
4. 关键细胞粘附分子NCAM1
神经细胞粘附分子1(NCAM1)是细胞粘附蛋白的重要成员,属于免疫球蛋白样细胞粘附分子家族,是最丰富的神经元粘附蛋白之一。NCAM1以NCAM1基因的可变剪接产生的三种主要同种型表达,两种同种型(NCAM140和NCAM180)是跨膜蛋白,NCAM120是锚定的糖基磷脂酰肌醇(GPI)(图5A)。作者首先通过WB实验确定来自DIV2至DIV21培养的大鼠海马神经元提取物中的同种型特异性蛋白质表达水平(图 5B )。和报道的研究结果一致,NCAM180是神经元中NCAM1表达的主要同种型,定量分析显示NCAM180在DIV5和DIV16显示两个主要的蛋白质表达峰(图 5C),这和组学定量结果一致,表明除了其在突触可塑性中的作用外,NCAM1在神经元发育的早期阶段(DIV5)可能也很重要。
为了进一步研究发育中的神经元(DIV1-DIV14)的NCAM1分布,作者进行了免疫荧光实验,结果表明NCAM1在2-3阶段细胞(DIV1)中显示出一些染色,其主要存在于轴突生长锥中。有趣的是,在DIV4-DIV5,许多神经元在树突生长锥中显示出强烈的NCAM1积累,在后期(DIV6-DIV8)又逐渐消失(图5D-F)。
图5 NCAM1及其在整个神经元发育过程中的表达
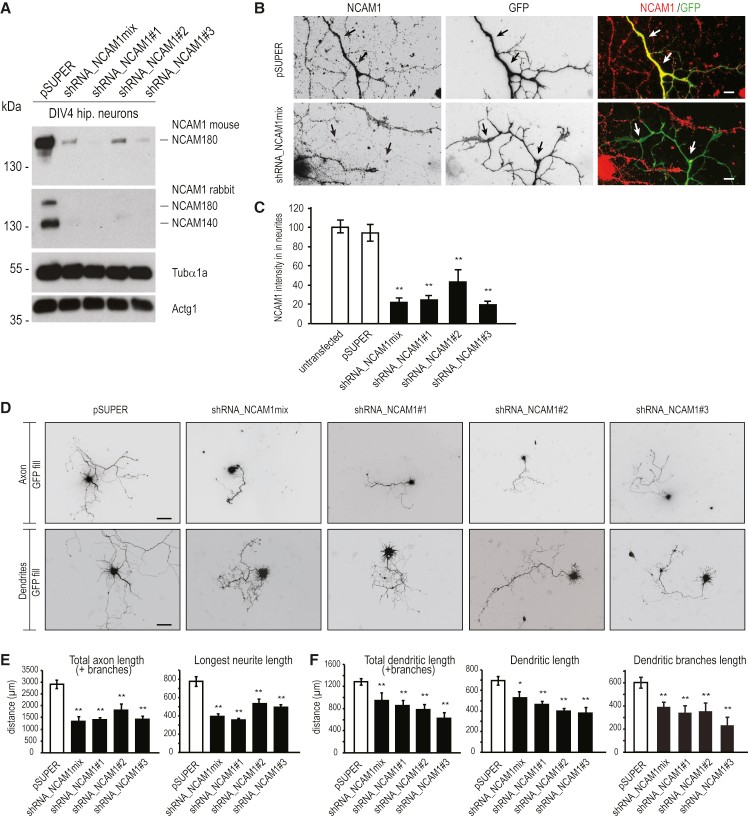
由于NCAM1在树突生长锥中累积,作者进一步研究了NCAM1在树突发育过程中的作用。基于NCAM180 mRNA大鼠序列设计并产生三种特异性短发夹RNA(shRNA)序列,进行敲低实验。如WB和免疫染色实验结果所示,所有三种shRNA(shRNA_NCAM1#1、shRNA_NCAM1#2和shRNA_NCAM1#3)将蛋白质水平降低80%(图6A–C),量化显示轴突的长度(图 6E)和树突的长度(图6F)与对照神经元相比显着降低,即NCAM1的缺失降低主树突、总树突和树突分支的长度。
图6 shRNA敲低神经元NCAM1
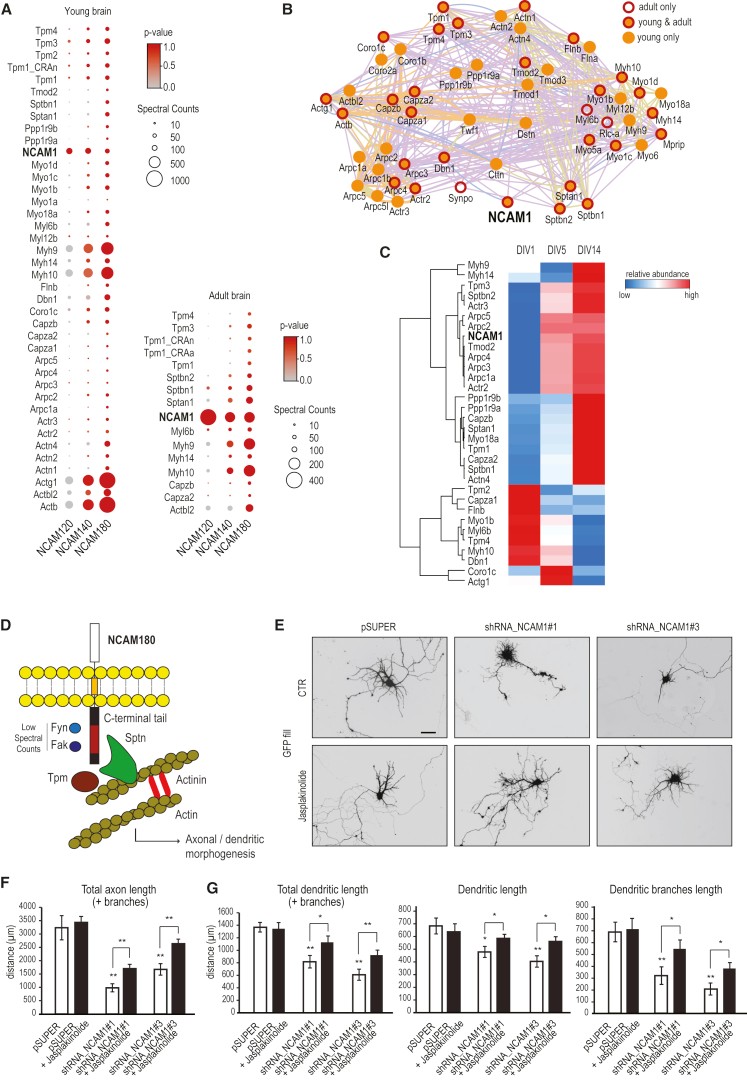
为了研究NCAM1影响树突发育的机制,作者在神经元中搜索了NCAM180结合配偶体,并使用另外两种同种型作为对照,通过亲合层析-质谱(AP-MS)分析鉴定真正的NCAM1结合伴侣,结果发现NCAM1互作的多为肌动蛋白-细胞骨架相关蛋白。值得注意的是,每个用作诱饵的NCAM1同种型的长度与鉴定的每种特异性肌动蛋白结合蛋白的相对丰度直接相关,从而证实NCAM180是参与调节树突中肌动蛋白动力学的主要参与者(图7A)。PPI分析可以清晰表明NCAM180与肌动蛋白的紧密联系(图7B),且这些肌动蛋白多存在于Cluter3并在DIV5上调(图 7C),表明它们可能在NCAM1信号传导中强烈配合。
为了研究NCAM1和肌动蛋白细胞骨架之间的潜在关系(图7D),作者利用稳定肌动蛋白纤维以促进肌动蛋白聚合药物Jasplakinolide处理NCAM1敲除细胞株。结果表明加入jasplakinolide可部分挽救由NCAM1耗竭引起的神经元发育缺陷(图7E-G),与对照神经元相比,在jasplakinolide处理的神经元中总树突长度、初生树突长度和树突分支长度显著增加。这表明,NCAM1通过在树突生长锥中促进肌动蛋白丝保持稳定来促进树突发育。
图7 NCAM1及其在肌动蛋白细胞骨架稳定中的作用
研究小结
本研究中作者定量到4534个蛋白质,超过三分之一蛋白在神经元分化期间经历了超过2倍的表达变化,表明神经元蛋白质组的广泛重塑。其中神经细胞粘附分子1(NCAM1)能够通过在树突生长锥中促进肌动蛋白丝保持稳定来促进树突发育。可见,定量蛋白质组学成为研究海马神经元发育特定阶段差异表达蛋白质分析的基础研究工具,将来可更好地用于神经发育的任何特定分子机制,进一步补充研究人员对神经元蛋白质动力学的理解。
解析文献
Christian K. Frese, Marina Mikhaylova, et al. Quantitative Map of Proteome Dynamics during Neuronal Differentiation. Cell Reports, 2017, 18(6): 1337-1586
参考文献
1. Boersema, P.J., Raijmakers, R., et al. Multiplex peptide stable isotope dimethyl labeling for quantitative proteomics. Nat. Protoc, 2009, 4, 484–494.
2. Choi, H., Larsen, B., et al. SAINT: probabilistic scoring of affinity purification-mass spectrometry data. Nat. Methods, 2011, 8, 70–73.
3. Low, T.Y., van Heesch, S., et al. Quantitative and qualitative proteome characteristics extracted from in-depth integrated genomics and proteomics analysis. Cell Rep, 2013, 5, 1469–1478.
4. Sharma, K., Schmitt, S., et al. Cell type- and brain region-resolved mouse brain proteome. Nat. Neurosci, 2015, 18, 1819–1831.